Микроскопия плоскостного освещения – методика, открывающая новые возможности в биологических исследованиях
Флуоресцентная микроскопия плоскостного освещения (lightsheetfluorescencemicroscopy, LSFM) использует тонкий фронт света для получения оптического среза образца прозрачных образцов – культур клеток, тканей и организмов, содержащих флуоресцентные молекулы [1]. Отсюда происходит название данного метода. Однако какие новые возможности даёт такой способ освещения? Дело в том, что, в отличие от большинства методов микроскопии, в данном случае освещается лишь небольшая часть образца. Свет, формирующий «срез» мало отклоняется в окружающее пространство. Таким образом, LSFM обеспечивает высокие значения соотношения сигнал/шум [2]Это также позволяет значительно снизить эффекты фотообесцвечивания и фототоксичности [1]. Флуорохромы при таком режиме освещения могут использоваться на протяжении больших промежутков времени [2], также не гибнет находящийся под объективом эмбрион Danio rerio и его развитие можно наблюдать часами и сутками, что не возможно при применении других методов микроскопии из-за его чувствительности к освещению [3]. Это касается и других фоточувствительных объектов.
Чтобы получить такое освещение материала, используются цилиндрические линзы. Проходящий через цилиндрическую линзу лазерный луч фокусируется только по одной координате [1]. С помощью объектива с высоким значением числовой апертуры можно получить «листы» света толщиной порядка 1,8 мкм и с низкой дифракцией [4]. Образец перемещается через освещённое пространство и производится съёмка поля зрения с использованием объектива, оптическая ось которого перпендикулярна световому срезу [5]. Система освещения может быть преобразована таким образом, чтобы единовременно освещалось множество слоёв, при условии, что между ними будет достаточное расстояние во избежание перекрывания сигналов [6]. Разрешение по оптической оси микроскопа гораздо ниже бокового разрешения, аналогично и «засвечивание» вне фокуса более выражено происходит по оптической оси системы. Поскольку освещение и наблюдение в случае микроскопии плоскостного освещения проводится по разным осям, разрешающая способность метода повышена, например, по сравнению с конфокальной микроскопией [2].
Особенностью систем для LSFM является размещение образца таким образом, чтобы его можно было поворачивать и наблюдать с различных сторон, например в прозрачных капиллярах, заполненных агарозным гелем [5]. Для полноценного обзора препарата необходимы моторизированные системы позиционирования обеспечивающие перемещения образца по трём осям и вращение с высокой точностью [2]. Возможны задачи, при которых перемещение препарата и скоординированная с ним съёмка флуоресценции камерой не будут проводится равномерно. В частности, одна из областей исследований, в которой наиболее востребованы методы микроскопии плоского освещения – эмбриология. Здесь метод применяется для длительного наблюдения развития прозрачных эмбрионов различных животных. При использовании замедленного сканирования центральных областей эмбриона и более быстрого сканирования его периферических частей, вне зависимости от области исследования, сигнал будет более однороден – без засвечивания по краям и с полноценным сбором данных о более плотной центральной части [3]. Возможность поворачивать образец, освещая его с разных углов, помогает избежать аберраций изображения из-за наличия в тканях непрозрачных структур [1], и позволяет глубже «проникнуть» вглубь образца, в отличие от других методов микроскопии, при которых образец перемещается только по двум осям [2].
Большая часть методов микроскопии высокого разрешения основана на сканировании [6]. В отличие от сканирующей конфокальной микроскопии и других методов, при микроскопии плоскостного освещения изображение снимается не по пикселю, а сразу со всего освещённого среза с использованием камеры ПЗС. В конфокальном микроскопе, благодаря системе детекции, исключающей влияние флуоресценции из областей вне интереса с целью повышения разрешающей способности, большая часть света не попадает на матрицу, однако препарат травмируется сильным освещением. При микроскопии плоскостного освещения попадание света вне области интереса минимизировано [2]. Выделение ионов кальция при сокращении мышечных волокон, укладка белковой молекулы, движение компонентов аппарата Гольджи – быстрые процессы, длительность которых измеряется долями секунды [6]. Быстрым способом исследования пространственно-временной динамики является спиннинг-диск микроскопия, но с помощью этого метода можно исследовать лишь поверхностные слои объекта, увидеть все слои такой культуры данным методом не удастся [5]. Благодаря отказу от сканирования препарата, микроскопия плоскостного освещения хорошо подходит для решения данной задачи.
Двухфотонная система также может работать в формате плоскостного освещения. Инфракрасный свет меньше рассеивается, чем видимый. При использовании фемтосекундных инфракрасных лазеров возможно наблюдение генерации второй и третьей гармоник, что позволяет вести ряд исследований без применения меток. Генерация второй гармоники происходит в волокнах коллагена, миофиламентах, астроглие, тубулине, в том числе и в веретёнах деления. Третью гармонику могут генерировать плотные гидрофобные объекты, такие как капли жира. Генерация второй гармоники не исчерпывается при длительном освещении, в отличие от флуорохрома[3].
Сложные клеточные культуры, модели тканей in vitro могут иметь достаточно большую толщину, измеряемую сотнями микрон. Проблемой при работе со сложными трёхмерными культурами нейронов является ещё и их высокая способность к светорассеянию. Применение метода микроскопии плоскостного освещения может помочь преодолеть данные трудности, позволяя наблюдать даже за сложными по структуре трёхмерными культурами клеток нервной ткани и сфероидами различного происхождения [5]. Обладая высокой разрешающей способностью, микроскопия плоскостного освещения может использооватться для отслеживания перемещений отдельных флуоресцентно меченых молекул.[4]
- Santi PA. Light sheet fluorescence microscopy: a review. J Histochem Cytochem. - 2011. - N.59, V.2. - P.129-38.
- Reynaud EG, Krzic U, Greger K et al. Light sheet-based fluorescence microscopy: more dimensions, more photons, and less photodamage. HFSP J. - 2008. - N.2, V.5. - P.266-75.
- Supatto W, Truong TV, Débarre D et al. Advances in multiphoton microscopy for imaging embryos. Curr Opin Genet Dev. - 2011. - N.21. V.5. - P.538-48.
- Li Y, Hu Y, Cang H. Light sheet microscopy for tracking single molecules on the apical surface of living cells. J Phys Chem B. - 2013. - N.117, V.49. - P.15503-11.
- Gualda EJ, Simão D, Pinto C et al. Imaging of human differentiated 3D neural aggregates using light sheet fluorescence microscopy. Front Cell Neurosci. - 2014. - 8:221.
- Mohan K, Purnapatra SB, Mondal PP. Three dimensional fluorescence imaging using multiple light-sheet microscopy. PLoS One. - 2014. - N.9, V.6. - e96551.
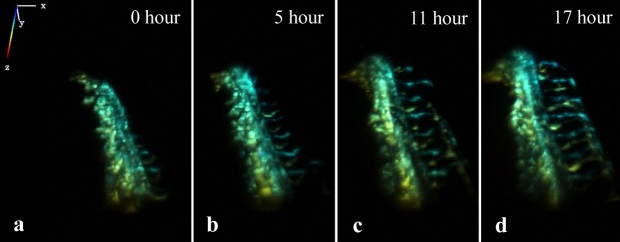
Формирование сосудов в хвосте эмбриона Danio rerio, изображение получено с помощью микроскопии плоскостного освещения в развивающемся эмбрионе.
Zhao M, Zhang H, Li Y et al. Cellular imaging of deep organ using two-photon Bessel light-sheet nonlinear structured illumination microscopy. Biomed Opt Express. - 2014. N.5, V.5. - P. 1296-308.
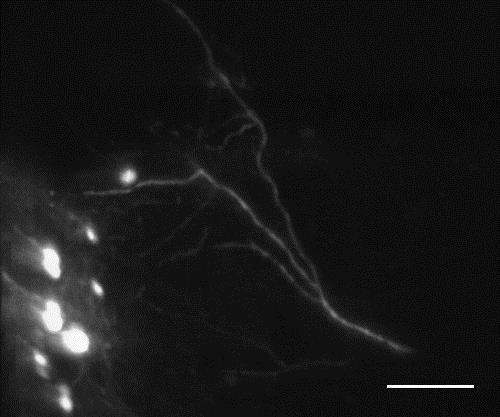
Клетки Пуркинье в мозжечке мыши, изображение получено с помощью микроскопии плоскостного освещения в целом обесцвеченном мозге мыши.
Silvestri L, Bria A, Costantini I et al. Micron-scale resolution optical tomography of entire mouse brains with confocal liо ght sheetmicroscopy. J Vis Exp. – 2013.
Полезная информация:
Микроскоп цена в Санкт-Петербурге
Микроскоп бинокулярный лабораторный

