Флуорохромы. Восстановление флуоресценции после обесцвечивания (FRAP)
Флуорохромы — это вещества, применяемые в флуоресцентной микроскопии.
Под фотообесцвечиванием понимают разрушение флуорохромов светом. Этот процесс осуществляется путём 1 – 5 вспышек лазера с интенсивностью, повышенной, по сравнению с применяемой в обычной флуоресцентной микроскопии, в 100 – 1000 раз [1]. Обесцвечивание проводится светом лазера высокой интенсивности, после чего наблюдение восстановления флуорохром погашенной флуоресценции проводится при освещении светом низкой интенсивности [2]. Процесс восстановления флуоресценции связан не с обратной реакцией, происходящей во флуорохроме, выгорание флуорохрома необратимо, а с миграцией других меченых молекул в обесцвеченную область. Такой метод оценки динамики молекул называют восстановлением флуоресценции после обесцвечивания (Fluorescencerecoveryafterphotobleaching, FRAP). Система для осуществления FRAP должна быть оснащена аттенюаторами для быстрого переключения интенсивности освещения [1]. Сделать обесцвечивание участка образца более точным можно, например, фокусируя в одной точке два лазерных пучка. Тогда эффект вне фокуса будет минимальным. [2] Всегда также следует учитывать, что при фотообесцвечивании возможны артефакты: под действием света образуются свободные радикалы, локально разрушаются белки и повышается температура, прежде всего на мембранах [3].
Для экспериментов с применением фотобесцвечивания могут использоваться многие широко употребляющиеся для решения других задач флуорохромы. Флуоресцентные белки – зелёный флуоресцентный белок GFP и его производные – стабильные яркие, нетоксичные флуоресцентные метки, позволяющие длительно отслеживать перемещение молекул в живой клетке. Внесение таких меток осуществляется путём создания фьюжн-конструкций из целевого белка и флуоресцентного белка. При этом интересующий исследователей белок, как правило, полностью сохраняет свою функцию. Единственным недостатком является эмиссия флуоресценции с момента сборки белка и до его деградации, из-за этого флуоресцентная метка включается ещё до полного созревания исследуемого белка и его прибытия к месту, где он будет выполнять свою функцию. Если, например, белок флуорохромы функционирует только во встроенном в мембрану состоянии, для повышения точности исследования используют метки, способные к абсорбции фотона только при нейтральных значениях pH. Благодаря этому белок становится видимым только после выхода в нейтральную среду на поверхности мембраны из цитоплазмы с кислыми значениями pH. Один из таких белков флуорохромы- pHluorin (SEP), производная GFP, используемая для визуализации белков мембраны [1].
Восстановленная флуоресценция флуорохромы, как правило, менее интенсивна, чем флуоресценция до обесцвечивания. Это связано с тем, что молекулы одного соединения подвижны в разной мере, и, зачастую, в области обесцвечивания присутствует как подвижная, так и неподвижная фракция. Что касается длительности восстановления флуоресценции, она может быть различной. В клеточной биологии адекватное время наблюдения измеряется минутами и часами. На молекулярном уровне отдельные межмолекулярные взаимодействия и внутримолекулярные перестройки происходят гораздо быстрее – в течении микросекунд и наносекунд [3]. Например, большинство белков флуорохромы в ядре восстанавливают флуоресценцию в течение нескольких секунд, в то время как для гистонов этот процесс может затягиваться на часы [4, 5].
Скорость перемещения белка флуорохромы зависит и от вязкости среды и взаимодействий с другими молекулами, прежде всего, белками, и от натяжения мембраны, если перемещение происходит в ней. Для исследования влияния отдельных факторов на подвижность белков их помещают в матрикс, мимикрирующий естественные условия, однако экстраполировать результаты, полученные таким образом на реальные процессы, протекающие в клетке, следует с осторожностью [2]. Метод FRAP позволяет наблюдать белки в составе живых клеток, сложных системах, где на их динамику влияет ряд факторов. Например, и липиды и белки флуорохромы перемещаются в мембранах под контролем цитоскелета. Движение молекул более интенсивно происходит в рамках определённых участков мембраны, обмен между такими компартментами куда менее интенсивен. Фотообесцвечивание подходит также для оценки разнообразных белков в цитоплазме и ядре, взаимодействия лигандов с рецепторами. [3], динамики хроматина [5]. Однако не только белки флуорохромы представляют интерес в живых организмах. Имеет значение имеет динамика липидных молекул, в частности, в мембранах, где липиды выполняют не только структурную, но и сигнальную функцию. Для исследования таких процессов используют молекулы липидов, конъюгированные с органическими красителями, которые вносят в среду invitro. При использовании фотообесцвечиваемых органических флуорохромов FRAPможно применять и для исследования динамики мембранных липидов. [3]
Методика FRAP для исследовани] флуорохромы может применяться как в сочетании с эпифлуоресцентной микроскопией, так и с более сложными технологиями микроскопии – конфокальной микроскопией, микроскопией полного внутреннего отражения, двухфотонной микроскопией. TIRF – метод, оптимальный для наблюдениями за процессами на мембране. В поле зрения при применения этого метода попадают лишь события в тонком слое под покровным стеклом. Двухфотонная микроскопия позволяет наблюдать процессы происходящие в клетках и тканях, проникая на глубину до 1 мм, при этом очень точно располагать поле зрения по вертикальной оси, избегая «засвета» из окружающих участков препарата благодаря тому, что сфокусированный луч инфракрасного лазера возбуждает флуоресценцию лишь в фокальной плоскости. [3] Преимуществом конфокальной микроскопии для исследования флуорохромы с применением метода FRAP – быстрое получение изображения и высокая разрешающая способность во времени при щадящем воздействии на клетки [6]. Однако с помощью микроскопа, оснащённого спиннинговым диском, нельзя провести собственно процедуру фотобесцвечивания флуорохромы. Для неё необходимо интенсивное облучение одного точно определённого участка препарата на протяжении некоторого времени. Дополнение такой системы оборудованием для активного освещения может помочь обойти данное ограничение. Системы активного освещения позволяют не только доукомплектовать микроскоп таким образом, чтобы на нём стала возможной реализация методики FRAP, но также в случае отдельных моделей, проводить фотобесцвечивание в определённых участках образца, даже если они неправильной формы, не повреждая и не обесцвечивая структур вокруг них.
- González-González IM, Jaskolski F, Goldberg Y et al. Measuring membrane protein dynamics in neurons using fluorescence recovery after photobleach. Methods Enzymol. – 2012. – N.504. – P. 127-46.
- Rayan G, Guet JE, Taulier N et al. Recent applications of fluorescence recovery after photobleaching (FRAP) to membrane bio-macromolecules. Sensors (Basel). – 2010. – N.10. V.6. – P.5927-48.
- Sezgin E, Schwille P. Fluorescence techniques to study lipid dynamics. Cold Spring Harb Perspect Biol. – 2011. – N.3. V.11. - a009803.
- Mueller F, Mazza D, Stasevich TJ et al. FRAP and kinetic modeling in the analysis of nuclear protein dynamics: what do we really know? Curr Opin Cell Biol. – 2010. – N.22. V.3. – P.403-11.
- Deal RB, Henikoff S. Capturing the dynamic epigenome. Genome Biol. – 2010. – N.11. V.10. – P.218.
- Woods E, Courtney J, Scholz D, Hall WW, Gautier VW. Tracking protein dynamics with photoconvertible Dendra2 on spinning disk confocal systems. J Microsc. 2014 Dec;256(3):197-207.
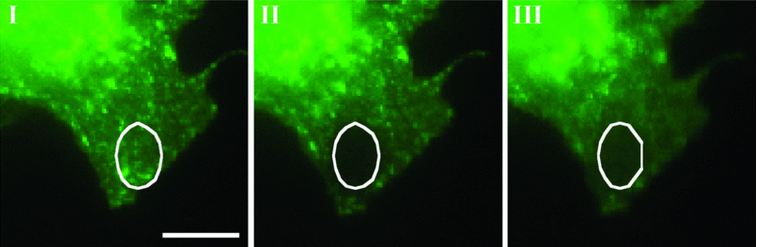
Восстановление флуоресценции белка EHD2 после фотообесцвечивания: I – контрольный кадр непосредственно перед фотообесцвечиванием, II – вид препарата непосредственно после процедуры фотообесцвечивания, III – восстановление флуоресценции в подверженной фотообесцвечиванию области. Участок, подвергнутый фотообесцвечиванию, выделен белым контуром.
S.Benjamin, H.Weidberg, D.Rapaport et al. EHD2 mediates trafficking from the plasma membrane by modulating Rac1 activity. - Biochem. J. - 2011 - N.439. – P.433–442.

Восстановление флуоресценции меченного потенциал-зависимого калиевого канала Kv1.4 в атриальном клапане после фотообесцвечивания.
O'Connell KM1, Whitesell JD, Tamkun MM. Localization and mobility of the delayed-rectifer K+ channel Kv2.1 in adult cardiomyocytes. Am J Physiol Heart Circ Physiol.- 2008. – N.294, V.1. – P.229-37.

