Методы микроскопии для исследования процесса метастазирования опухолей
Распространение опухоли в организме, сопровождающееся формированием отдалённых вторичных очагов опухолевого процесса, метастазов – процесс, определяющий тяжесть течения онкологического заболевания. Часто при метастазировании поражаются жизненно важные органы, метастазы оказываются неоперабельными и являются причиной смертельного исхода. Этот процесс обусловлен природой раковых клеток, покидающих первичную опухоль и распространяющихся в прилежащие ткани путём непосредственного контакта или в удалённые области организма – гематогенным или лимфогенным путём. Однако в понимании процесса метастазирования ещё довольно много белых пятен. Способностью к миграции обладают многие клетки организма. Этот процесс хорошо описан в фибробластах и других медленно передвигающихся клетках, однако в быстро мигрирующих опухолевых клетках описать его не так просто. Появление новых методов исследования, в частности, микроскопии, позволило получить ряд ценных сведений об этом процессе, и установить, что в основе его могут быть различные механизмы. [1]
Ряд факторов определяет склонность опухолевых клеток к миграции. При развитии злокачественной опухоли структура внеклеточного матрикса в ткани нарушается. Ранее считалось, что процесс метастазирования возможен только в области инвазивного края, однако прижизненное наблюдение привело к пересмотру данного мнения. В настоящее время, путём прижизненных наблюдений, установлено, что опухолевые клетки выходят как из инвазивного края опухоли, так и из опухолевой массы[2]. Прежде всего, метастазирование определяется особенностями самих опухолевых клеток. Активация таких хорошо изученных онкогенов, как тирозинкиназные рецепторы EGFR и HER2, а также c-Met, ассоциирована не только с интенсивной пролиферацией, но также с миграцией клеток опухоли, ведущей к её инвазии и метастазированию. Коллагеновые структуры облегчают миграцию опухолевых клеток, которые связываются с ними и перемещаются вдоль них. [3]Принципиальную роль в стимуляции и осуществлении миграции играют макрофаги. Они привлекают опухолевые клетки к сосудам и облегчают их выход в кровеносное русло[4] . Кровеносные сосуды, прорастающие в опухоль, имеют нарушенную организацию клеточной стенки, поэтому клетки, покидающие опухолевую массу, в отличие от клеток инвазивного края, не сталкиваются с такими барьерами, как базальная мембрана эндотелия, которые, однако, опухолевые клетки могут преодолеть, разрушая внеклеточный матрикс. Макрофаги также продуцируют цитокины и пептидазы, облегчающие выход опухолевых клеток в кровеносные сосуды[2]. Однако, миграция возможна и без разрушения клеточного матрикса, когда клетки приобретают амебоидную форму, и этот переход также стимулируется макрофагами[2; 4]. Более того, при схлопывании стенок сосудов в опухоли под давлением интерстициальной жидкости, не только отдельные клетки, но и крупные клеточные агрегаты могут проникать в их просвет пассивно. Лимфатические сосуды, в отличие от кровеносных, не проникают в опухоль, и, даже если они оказываются там, они не функционируют. Однако опухолевые клетки могут проникать в лимфатические сосуды на периферии опухоли и проходить через них в лимфатические узлы, откуда, затем, попав в кровеносное русло, распространяются в другие органы. С помощью модифицированных клеток и прижизненной микроскопии было установлено, что в кровеносное русло клетки мигрируют по одной, а в лимфатические сосуды входят скоординированными клеточными пластами.Фибробласты стромы перестраивают матрикс, обеспечивая коллективную миграцию клеток. В одной и той же опухоли, более того, в одной и той же клетке в различные моменты времени могут быть реализованы разные способы передвижения[2].
Наблюдение миграции клеток в культуре лишь приблизительно отражает реальную картину, которую можно наблюдать в тканях живого организма. Реконструкция условий, опухоли в культуре, тем не менее, позволяет стандартизировать условия эксперимента, что крайне важно для воспроизводимости результата и сравнения между повторами эксперимента [4]. В качестве моделей часто используются лабораторные мыши, в организме которых опухоль можно наблюдать в реальном времени и в естественных условиях – без нарушения кровотока, распределения градиентов цитокинов, ростовых факторов и т.д. Процессы развития опухоли изучаются также в прозрачных эмбрионах Danio rerio, в которых могут приживаться пересаженные опухолевые клетки человека [1]. Даже после оптимизации условий проведения операции невозможно наблюдать какие-либо процессы, протекающие в организме животного с помощью прижизненной микроскопии более суток. Однако применение специальных камер, встраиваемых в дорсальную кожную складку, позволяет вести более длительные наблюдения. Аналогичные системы, «окна», позволяют наблюдать за процессами, протекающими в мозге или молочной железе [2].
В самом простом случае для исследования миграции клеток может использоваться световая микроскопия и фазовый контраст. Фазовый контраст не вызывает повреждения клеток светом и подходит для длительного наблюдения. С помощью этих методов можно оценить скорость движения и сопутствующее ему изменение формы клеток. Современное программное обеспечение позволяет отслеживать перемещение единичных клеток в фазовом контрасте, однако применение флуоресцентных меток для этих целей, всё же, надёжнее [1]. Дифференциальная интерференционно-контрастная (ДИК) микроскопия - вариант световой оптической микроскопии, создающий контраст в неокрашенном материале, за счёт того, что поляризованный луч из источника света разделяется на два луча. Эти лучи проходят через образец разными оптическими путями, отличающимися, в том числе, по длине. Интерференция лучей при слиянии позволяет создать объемное рельефное изображение, соответствующее изменению оптической плотности образца. Отражательная конфокальная микроскопия позволяет напрямую, без меток исследовать образец, например на предмет расположения цитоскелетных структур в трёхмерном пространстве. Метод хорошо подходит для прижизненной микроскопии, в отличие от конфокальной микроскопии с флуоресцентными метками, и позволяет описывать процессы миграции клеток в динамике [3].
Использование различных типов флуоресцентных меток является незаменимым инструментом для исследования активности белков, сигнальных каскадов и клеточных процессов при метастазировании [2]. Это не только точный способ отслеживания поведения единичной клетки, но и, прежде всего, возможность увидеть отдельные молекулы и их взаимодействия с помощью меченных антител или разнообразных генетических конструкций. Когда какие-либо процессы, сопровождающиеся флуоресценцией, требуется оценить быстро, но требования к разрешению и увеличению изображения невелики, оптимальным методом может быть обычная флуоресцентная микроскопия. Однако этого часто этого бывает недостаточно и нужны методы, дающие большую детализацию. Конфокальная микроскопия, за счёт системы, включающей дихроичное зеркало и диафрагму с точечным отверстием, а также лазерного источника света, позволяет проводить исследование образца с точным позиционированием поля зрения по вертикали. При этом исключается флуоресценция, возбуждающаяся вне плоскости фокуса. Метод позволяет получить серию изображений, оптических срезов, на различной глубине и реконструировать трёхмерную структуру объекта, однако этот процесс более медленный, чем визуализация с помощью обычной флуоресцентной микроскопии [1]. Метод может использоваться и для прижизненной микроскопии, но воздействие света от лазерного источника при такой конструкции микроскопа обладает фотообесцвечивающим и фототоксическим эффектом. В основе спиннинг-диск конфокального микроскопа система из двух дисков, один из которых содержит микролинзы, а другой, вращающийся – отверстия. Свет от источника проходит через эту систему, и на образец проецируется серия из 1000 или более параллельных световых лучей. Флуоресценция детектируется после прохождения через ту же систему дисков. Метод отличает низкая фототоксичность, он может использоваться для наблюдений за живыми объектами, причём не только за клеточными культурами, но и за опухолевыми клетками in vivo. К сожалению, проникнуть более чем на 100 мкм вглубь образца с помощью данных технологий невозможно [2].Флуоресцентная микроскопия внутреннего отражения (total internal reflection fluorescence, TIRF) предназначена для оценки флуоресценции в тонкой области препарата, непосредственно контактирующей с покровным стеклом. Оптический срез при микроскопии TIRF приблизительно в 10 раз тоньше, чем оптический срез при конфокальной микроскопии. Это значительно снижает влияние фоновой флуоресценции на результат, но лежащие под поверхностью материала структуры так не визуализировать – в среднем, глубина проникновения для данного метода – 100 нм. Метод TIRF обладает очень высокой точностью, позволяющей увидеть отдельные молекулы [1].
Новые возможности с точки зрения разрешающей способности и глубины погружения в образец дали технологии, основанные на примени фемтосекундных инфракрасных лазеров. Мультифотонная микроскопия основана на способности флуорохромов поглощать два фотона инфракрасного спектра с излучением одного фотона видимого спектра. Вне фокальной плоскости мультифотонного микроскопа плотность фотонов низкая и флюоресценцию не возбуждает. Метод позволяет получать изображения на глубине до 1 мм и не повреждает ткань благодаря точной фокусировке и щадящего воздействия света длинноволнового спектра [2]. Для визуализации цитоскелета и внеклеточного матрикса применяется генерация второй гармоники. Как и при мультифотонном возбуждении, в этом случае происходит поглощение излучения импульсного инфракрасного лазера и излучение света с длиной в два раз короче, чем у поглощённого света. Коллаген, миозин и тубулин можно изучать таким способом благодаря их высокой структурированности. Следует учесть, что только структуры, не обладающие центральной симметрией, могут генерировать сигнал второй гармоники. Метод можно использовать в сочетании с двухфотонным возбуждением. Для более простых задач визуализация трёхмерного внеклеточного матрикса может успешно осуществляться путём микроскопии ДИК-контраста [3]. Микроскопия длительности затухания флуоресценции (fluorescence lifetime imaging, FLIM) основана на оценке времени свечения флуорохрома, а не спектра его эмиссии, поэтому позволяет анализировать окраску светящимися. метками, различающимися только по этому параметру. Метод также требует применения фемтосекундного инфракрасного лазера. В таких условиях близкие по спектру вторая гармоника, генерируемая биомолекулами и флуоресценция, например, фотопереключаемого белка Dendra2 могут быть разделены по длительности несмотря на спектральное перекрывание. Эта методика позволяет также различить нормальные и опухолевые ткани по длительности аутофлуоресцентного сигнала [2].
Значимую роль в метастазировании играют адгезивные белки. Признанным методом для исследования процессов адгезии на субклеточном уровне является фотообесцвечивание флуоресцентных меток на адгезивных белках в участках мембраны, за счёт которых клетки прикрепляются к матриксу с последующим наблюдением восстановления флуоресценции, то есть, фактически, динамики адгезивных белков в ходе движения. Использование фотопереключаемых белков позволяет индивидуально пометить интересующие единичные клетки и наблюдать за ними [1]. С помощью фотомаркирования определённой группы опухолевых клеток, например, удалось описать, как они перемещаются в опухоли и входят в сосуды [2]. Такие эксперименты проводятся с использованием систем активного освещения, дополнительных модулей, присоединяемых к микроскопу. С их помощью можно выжигать или переключать флуоресцентные молекулы в определённых точках и даже областях сложной формы в поле зрения микроскопа.
У каждой микроскопической техники могут быть свои особенности, поэтому для получения наиболее ясного результата их лучше использовать в сочетании, тем более что современное программное обеспечение позволяет это сделать. Процесс метастазирования регулируется не только опухолевыми клетками, важны для этого и клетки стромы. Тем более разнообразны сигнальные пути, управляющие им на молекулярном уровне. Микроскопические методы – важная составляющая методологической базы для исследования метастазирования и современное понимание этого процесса, во многом – результат развития данной области. Исследование механизмов метастазирования, помимо фундаментальной значимости имеет ещё и важный практический смысл: поиск ключевых компонентов сигнальных путей, ответственных за этот процесс – это и поиск потенциальных мишеней таргетной терапии, направленной против метастазирующих опухолей [1].
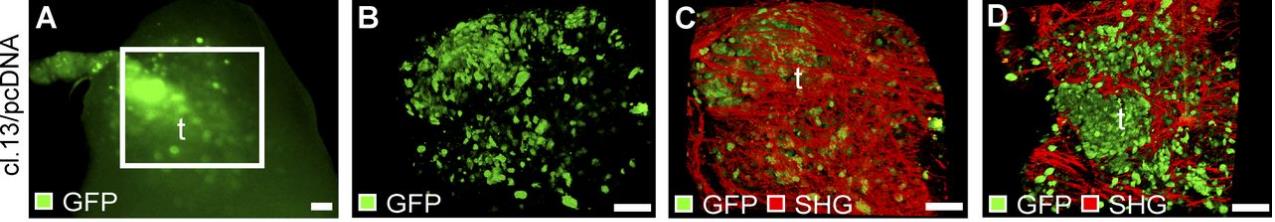
Миграция опухолевых клеток в лимфатический узел мыши. Прижизненная визуализация при помощи мультифотонного микроскопа. Опухолевые клетки окрашены GFP, визуализация структур внеклеточного матрикса – за счёт генерации второй гармоники. Das S1, Sarrou E, Podgrabinska S et al. Tumor cell entry into the lymph node is controlled by CCL1 chemokine expressed by lymph node lymphaticsinuses. J Exp Med. 2013. – N. 210, V.8. – P.1509-28.
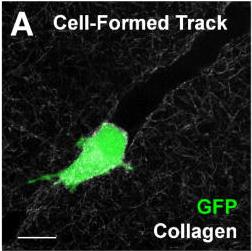
Разрушение коллагена мигрирующей опухолевой клеткой. Клетка окрашена GFP, волокна коллагена визуализированы путём генерации второй гармоники. Конфокальная микроскопия, зафиксированный препарат. Kraning-RushCM1,CareySP, LampiMCetal.. Microfabricated collagen tracks facilitate singlecell metastatic invasion in 3D. Integr Biol (Camb).2013.– N.5. V.3. – P.606-16.
Полезные материалы:

